Projekt B1
T-Zellen als regulierendes Element während des Ausbruchs der Autoantikörper-vermittelten Arthritis
Unsere veröffentlichten Daten aus der ersten Förderperiode von PANDORA haben geweberesidente entzündungshemmende Cx3cr1+- Makrophagen identifiziert, die schützende Barrieren um Synovialgelenke bilden und das Auftreten von Autoantikörpervermittelter Gelenkentzündung unter homöostatischen Bedingungen verhindern. Unsere vorläufigen Daten zeigen, dass autoreaktive T Zellen mit solchen barrierebildenden synovialen Cx3cr1+Makrophagen interagieren bevor die Entzündung einsetzt. Dadurch wird die lokale Entzündungsschwelle gesenkt und das synoviale Gewebe über die Produktion von Granulozyten-Makrophagen-Kolonie-stimulierendem Faktor (GM-CSF) für die Autoantikörperinduzierte Arthritis „lizenziert“. In der zweiten Förderperiode wollen wir daher die GM-CSF-abhängigen molekularen Mechanismen und reagierenden synovialen Zelltypen entschlüsseln, die den Beginn der Autoantikörper-induzierten Arthritis ermöglichen. Desweiteren planen wir zusätzlich, die Relevanz der zugrundeliegenden Prozesse für die menschliche RA zu bestimmen.
2019-2022 (1. Förderperiode):
Die Mechanismen, die zum Ausbruch von Autoantikörper-vermittelten Erkrankungen wie der rheumatoiden Arthritis (RA) beitragen sind unzureichend verstanden. Unsere Vordaten zeigen, dass autoreaktive T-Zellen einen wesentlichen Einfluss auf Autoantikörper-vermittelte entzündliche Prozesse in experimentellen Arthritismodellen ausüben. Obwohl die genauen Mechanismen unklar sind, scheinen hierbei IL-23-abhängige autoreaktive T-Zellen von Bedeutung zu sein welche das Gelenk für eine Autoantikörper-vermittelte Entzündung sensibilisieren bzw. lizenzieren.
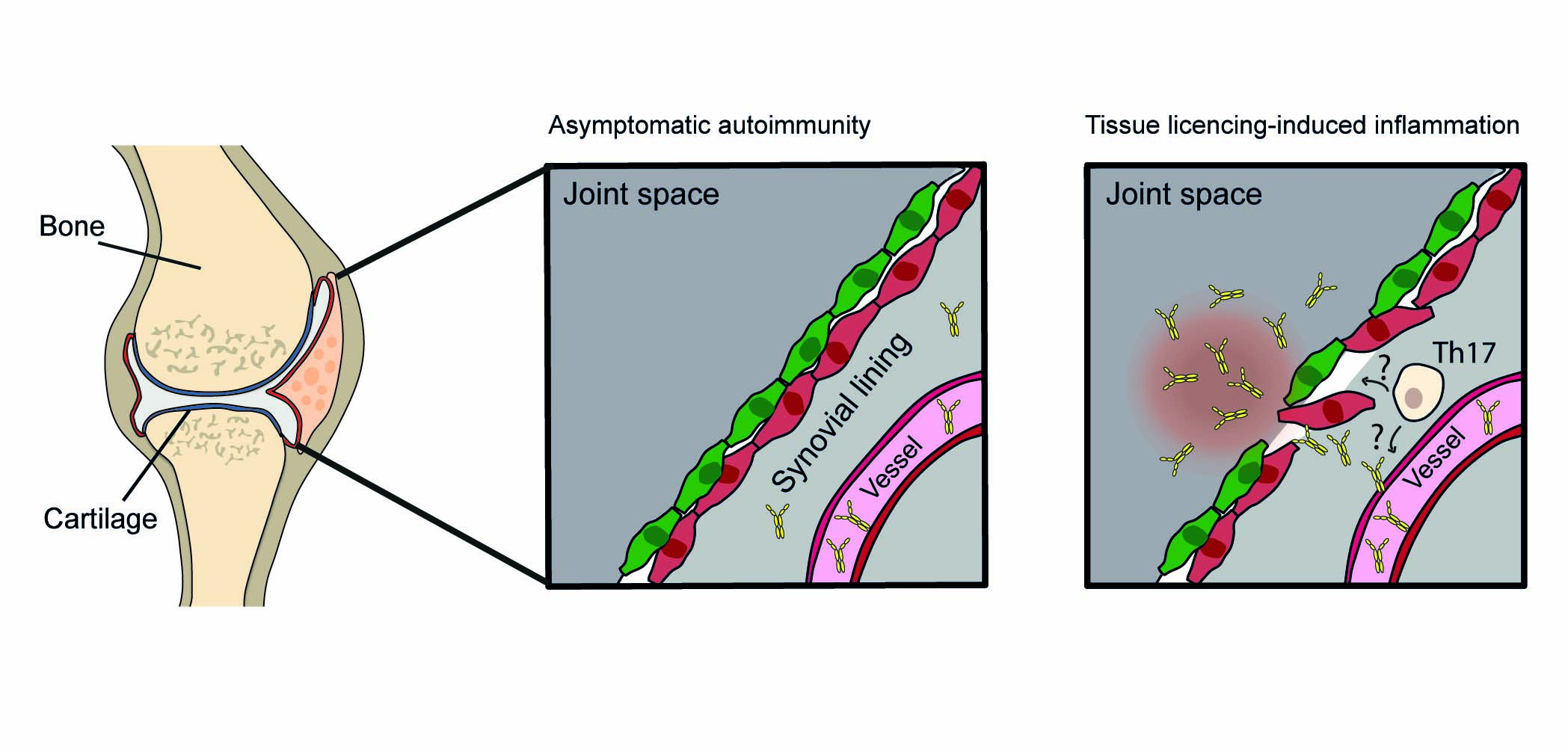
Unsere Daten zeigen, dass Autoantikörper und autoreaktive T-Zellen in synergistischer und Antigen-spezifischer Weise interagieren. In diesem Projekt sollen die verantwortlichen T-Zell Subpopulationen charakterisiert und die T-Zell-abhängigen Effektor-Mechanismen identifiziert werden. Im Speziellen ist der Einfluss autoreaktiver T-Zellen auf den Übertritt von Autoantikörpern ins Gewebe und die Antikörperaktivität sowie die Bedeutung dieser Prozesse für die RA von Interesse.
Dr. rer. nat. Rene Pfeifle
Medizinische Klinik 3 - Rheumatologie und Immunologie
Lehrstuhl für Innere Medizin III
- Telefon: 0913185-2913185-39352
- E-Mail: rene.pfleifle@uk-erlangen.de
Alexandra Klej
Medizinische Klinik 3 - Rheumatologie und Immunologie
Lehrstuhl für Innere Medizin III
- Telefon: +49 9131 85-39107
- E-Mail: alexandra.klej@uk-erlangen.de



