Projekt A4
Auswirkungen von IgA und IgG ACPA auf das Immunsystem und den Ausbruch von Krankheiten
In der ersten Förderperiode haben wir entdeckt, dass IgA2 eine stärkere entzündungsfördernde Wirkung hat als IgA1 und dass ACPA (Antikörper gegen citrullinierte Proteine) einen höheren IgA2-Anteil im Vergleich zum gesamten Serum-IgA aufweisen. Der IgA2-Anteil in ACPA korrelierte mit dem Schweregrad der Erkrankung bei RA-Patienten mit etablierter Erkrankung und mit dem Schweregrad eines Rückfalls nach Remission. Interessanterweise sinken die Serum-ACPA-Spiegel des IgA- und IgG-Isotyps zu Beginn der RA, was ein Zeichen für eine verstärkte Transmigration von ACPA aus dem Serum in betroffenes Gewebe wie die Synovialis sein könnte. In einem Modell der submaximalen kollageninduzierten Arthritis (CIA) erhöhte eine Koimmunisierung gegen citrulliniertes Vimentin die Inzidenz und den Schweregrad der Erkrankung, was darauf hindeutet, dass ACPA direkt zum Ausbruch der Arthritis beitragen. In der zweiten Förderperiode wollen wir daher die Auswirkungen von IgA- und IgG-ACPA auf den klinischen Ausbruch von RA weiter untersuchen. Wir wollen die Auswirkungen der (Auto-)Immunität gegen citrullinierte Proteine auf das adaptive und angeborene Immunsystem sowie die Synovitis anhand des Mausmodells der submaximalen CIA untersuchen. Darüber hinaus werden wir räumliche und zeitliche Veränderungen in der Expression von ACPA-Antigenen im Synovialgewebe rund um den Ausbruch der Arthritis analysieren. Die Ergebnisse werden auf Patienten mit verschiedenen Stadien der Prä-RA und der etablierten RA übertragen.
2019-2022 (1. Förderperiode): Die Rolle von IgA in der rheumatoiden Arthritis
Während der Einfluss von IgG-Autoantikörpern bei der Entstehung der rheumatoiden Arthritis (RA) relativ gut untersucht ist, ist über die Rolle von IgA-Autoantikörpern in diesem Zusammenhang weit weniger bekannt. In diesem Projekt planen wir die Rolle von IgA mit Bezug auf die RA zu entflechten, wobei wir uns auf die Subklassen IgA1 und IgA2 fokussieren.
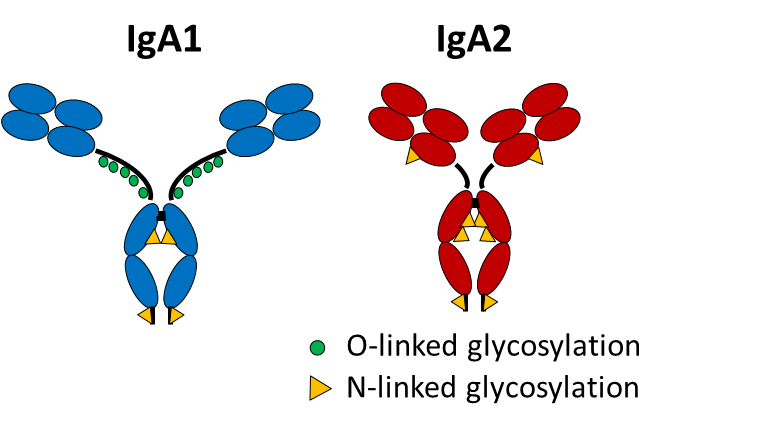
Unsere vorläufigen Daten deuten auf ein erhöhtes Verhältnis von IgA2- zu IgA1-Autoantikörpern im Serum von RA-Patienten hin, das mit der Krankheitsaktivität korreliert. IgA2, aber nicht IgA1, aus menschlichem Serum löst entzündliche Effekte in Makrophagen und neutrophilen Granulozyten aus. Diese Befunde sprechen dafür, dass das Einsetzen der RA durch einen Wechsel von immunregulatorischen IgA1 zu pro-inflammatorischen IgA2-Antikörpern charakterisiert ist, wobei IgA2 unter den RA-spezifischen Autoantikörpern angereichert ist. Das Ziel des Projektes ist es, die Rolle der genannten IgA-Autoantikörper-Subklassen in der RA zu analysieren. Ein besonderer Fokus liegt hierbei auf der Rolle von IgA2 während des Übergangs von der Autoimmunität zur Entzündung.
Dr.rer.nat. Ulrike Steffen
Medizinische Klinik 3 - Rheumatologie und Immunologie
Lehrstuhl für Innere Medizin III
- Telefon: +49 9131 85-39165
- E-Mail: ulrike.steffen@uk-erlangen.de
Rico Zapf
Medizinische Klinik 3 - Rheumatologie und Immunologie
Lehrstuhl für Innere Medizin III
- Telefon: +49 9131 85-33795
- E-Mail: rico.zapf@uk-erlangen.de
Maria Sokolova
Medizinische Klinik 3 - Rheumatologie und Immunologie
Lehrstuhl für Innere Medizin III
- Telefon: +49 9131 85-33795
- E-Mail: maria.sokolova@uk-erlangen.de



